Глава
5. ЭНЕРГООПТИМАЛЬНАЯ ГАРМОНИЯ, КАПИЛЛЯРНЫЙ УЧАСТОК И СЕРДЕЧНАЯ ТКАНЬ
5.1. Особенности организации капиллярного участка
Сердечная мышца содержит исключительно
большое количество капилляров. Капилляры составляют в среднем 7,3% объема
миокарда млекопитающих /Кирьянов и др., 1990/. Величина кровотока в единичном
объеме миокарде намного превосходит таковую в скелетных мышцах. Количество
капилляров примерно равно количеству мышечных волокон /Hort, 1955/.
Капилляры находятся в тесном контакте с кардиомиоцитами;
каждое мышечное волокно находится в окружении 3-4 капилляров. Стенки капилляров
состоят из одного слоя плоских эндотелиальных клеток. Их наружная поверхность
лежит на базальной мембране, которая образована непрерывным слоем основного
вещества, расположенного между эндотелием и окружающими структурными элементами
ткани. Слой гладкомышечных клеток в стенках терминальных артерий постепенно
утончается; мышечные клетки в нем становятся все более редкими в области стенок
переходных отделов артериол в капилляры. В составе
стенок кровеносных капилляров нет специализированных сократительных элементов
типа мышечных и поэтому капилляры не могут изменять сосудистый просвет, как это
имеет место в артериальных сосудах и артерио-венозных анастомозах. Отдельные
мышечные клетки у начала ветвящегося капилляра называются прекапиллярными
сфинктерами. Эти мышечные структуры обеспечивают подключение
дополнительного количества капилляров при увеличении коронарного кровотока.
Капилляры при этом находятся в трех последовательных состояниях: 1) закрытые
капилляры, просвет которых сужен полностью или почти полностью; 2)
плазматические капилляры, диаметр которых обычно остается нормальным (или
несколько суженным), но в их просвете течет только плазма крови без
эритроцитов; 3) функционирующие или активные капилляры, содержащие ток цельной
крови (т.е. плазмы с форменными элементами) в сосудистом просвете /Мчедлишвили, 1989/. Плазматические капилляры не участвуют в
доставке кислорода к тканям. Установлено также, что существует физиологический
механизм, позволяющий периодически включать и выключать капилляры, артериолы, венулы и мелкие
артерии и вены таким образом, что среднее количество фунционирующих
сосудов сохраняется постоянным, если также сохраняется постоянным потребление
кислорода и другие факторы, определяющие потребность в кровоснабжении /Чернух и
др., 1975; Мчедлишвили, 1989/.
Несомненно, что для организации
капиллярной сети определяющими является и гемодинамика, и метаболизм. С этой
точки зрения каждый капилляр одновременно является звеном двух «цепочек»
сосудов – «гемодинамической» и «диффузионной». Первая представляет
последовательность сосудов, по которой отдельный эритроцит доставляет кислород
к капилляру. Вторую цепочку составляет множество последовательно соединенных
капилляров, параллельных мышечному волокну. Анализ первой цепочки позволяет
установить особенности гемодинамического сопряжения терминальных артериол и капилляра. Выявление количественных взаимосвязей
во второй цепочке открывает возможность показать особенности «кислородного»
сопряжения сердечных капилляров и мышечного волокна. Ниже будет показано
оптимальное сопряжение гемодинамических, кислородных и пространственных
параметров капиллярной системы сердца млекопитающих.
Капилляры представляют собой самую
существенную часть микрососудистого русла сердца. Именно из капилляров в ткани поступает
основная часть потребляемого кислорода (более 80%). Адекватное кислородное
обеспечение сердечной ткани зависит от:
1)
плотности сети открытых капилляров;
2)
скорости движения эритроцитов в капиллярах;
3)
напряжения кислорода в притекающей к капиллярам крови;
4)
сегмента кривой дезоксигенации гемоглобина,
соответствующего капилляру;
5) величины
коэффициента диффузии и коэффициента растворимости кислорода в данной ткани.
Плотность расположения капилляров,
строение капиллярной стенки, а так же рисунок капиллярной сети, обусловлены
рабочей функцией органа /Куприянов, 1969/. Организация капиллярного русла
сердца млекопитающих в настоящее время достаточно хорошо изучена. Несмотря на
значительные различия в степени васкуляризации
отдельных регионов сердца, организация гемокапиллярного
русла имеет черты, общие для всего объема миокарда:
1. Капиллярное русло миокарда состоит из
обменных (d=5-7
мкм) и магистральных капилляров (диаметр до 20 мкм). В магистральных капиллярах
кровь движется в 2-3 раза быстрее /Куприянов и др., 1975/. Эти капилляры
аналогичны обменным, однако имеют больший диаметр и меньшую длину /Hyman, 1971; Куприянов и др., 1975; Чернух и
др., 1975/. Магистральные капилляры, соединяющие артериолы
и венулы, не являются фиксированными структурами
микроциркуляторного русла, а временно возникают на том или ином участке,
выполняя роль шлюзов, открывающих путь для прямого перехода артериальной крови
в венозный отдел системы. Таким образом, действующее капиллярное русло миокарда
можно подразделить на обменные капилляры, в которых осуществляется газоообмен, и магистральные, исполняющие роль шунтов.
Примерно 1/4 всех сосудов микроциркуляторного русла функционирует в качестве
шунтов /Zweifach, 1971/.
2. Кровь в капиллярах является
неньютоновской жидкостью. Движение крови в капиллярах имеет
вращательно-поступательный характер /Куприянов, Ананин,
1988; Гареев и др., 1999/.
3. Сердечной мышце присущ линейный порядок
капилляров. Капилляры вытянуты по ходу мышечных волокон и приблизительно
параллельны друг другу /Джавахишвили, Комахидзе,
1967; Toborg et al., 1972/.
4. В сердечной мышце имеет место
асимметричное расположение соседних капилляров, при котором артериальные и
венозные концы капилляров смещены относительно друг друга /Fabel, 1968; Toborg, 1972; Гавриш, 1984/.
5. Размеры капилляров неизменны по всему
объему сердца /Tomanek et al., 1986/.
6. Независимо от степени механического
сжатия диаметр, длина, площадь и конфигурация внутренней поверхности капилляров
остаются неизменными /Куприянов, 1969; Tilton et al., 1986/.
7. Диаметр и длина сердечных капилляров
одинаковы для различных видов млекопитающих /Кирьянов и др., 1990/.
8. Плотность капиллярной сети в сердечной
мышце тем больше, чем меньше вес животного /Roy, Popel, 1996/.
9. В случае возрастания активности сердца
количество открытых капилляров увеличивается /Gregg, Fisher, 1963; Barnard et al., 1977/.
Многие исследователи отмечают удивительное
сходство архитектоники капиллярного русла сердца у различных видов
млекопитающих /Джавахишвили, Комахидзе, 1967; Toborg, 1972; Каро и др., 1981/. Интересно отметить золотое
соотношение крово-кислородного обеспечения между
правым и левым желудочками. Установлено /Henquell, Honig, 1976; Canby, Tomanek, 1989/, что кровоснабжение
На входе артериальной системы всегда присутствует
значительная пульсация давления. На уровне артериол
пульсация очень сильно снижается, а в капиллярах практически отсутствует /Каро и др., 1981/. По мнению
В.В.Куприянова /Куприянов, Караганов, 1969/
отсутствие пульсаций на уровне артериол и капилляров
сердца имеет физиологическое обоснование, поскольку резкие пульсовые колебания
могут неблагоприятно повлиять на проводящую систему сердца. Эффективное гашение
пульсовой волны до капилляра обеспечивается в значительной степени за счет
извитого пути артериол /Гавриш,
1984/ и жестких стенок микрососудов. Сглаживание пульсовых колебаний
обеспечивает постоянство параметров архитектоники и гемодинамики в течение кардиоцикла. Таким образом, отпадает необходимость
раздельного анализа параметров в течение систолы и диастолы. В дальнейшем при
анализе нами будут использоваться значения параметров, усредненные за
сердечный цикл.
5.2. Артерио-капилярные
тройники
5.2.1 Артерио-капилярные
тройники в золотом режиме гипертензии
Большой интерес представляют тройники на стыке между
обменным и капиллярным участками. Стволом в этих тройниках является прекапиллярная артериола, ветвями
- капилляры. В артерио-капилярных тройниках имеет
место симметричное ветвление. В соответствии с критерием «минимальной работы»,
dK(bЗС)=0,794dС(bЗС).
Это
соотношение аналогично полученному ранее для обменного участка. Однако
коэффициент конструкции капилляра во много раз превосходит таковой для ствола (l/d≈40).
Вследствие этого,
lK(bЗС)>0,794lС(bЗС).
Более того, «нестандартное» удлинение
капилляра не компенсируется полностью за счет уменьшения вязкости крови, как
это имеет место в обменных артериолах, а лишь
частично. Естественно возникает вопрос: соблюдаются ли на капиллярном участке
универсальные инварианты, присущие транспортному и обменному участкам? Покажем,
что и в таких тройниках эти инварианты частично сохраняются.
Исходя из bK(bЗС)=19.300 эрг см3 с-1
/Murray, 1926b/, tK(bЗС)=0,25 cек
/Цветков, 1993/ и dK(bЗС)=5,5×10-
Величина коэффициента оптимальной перфузии
aK(bЗС)=160 с-1. Значение коэффициента aK(bЗС) всего на 1% отличается от артериальной
величины a(bЗС) =162 с-1. Таким образом, можно сказать, что
коэффициент a(bЗС)=162 с-1 является универсальной величиной как
для артерий и артериол, так и для капилляров.
Коэффициент aK(bЗС) характеризует
гармонию энергооптимального вхождения параметров
архитектоники и гемодинамики в систему «Артерио-капиллярный тройник».
Рассмотрим другие энергетические соотношения
(инварианты). Механическая мощность, расходуемая на перфузию капилляра,
WМK(bЗС) = = 0,5lKmKWМC(bЗС), (5.1)
где WМC(bЗС), WМK(bЗС) –механическая мощность, расходуемая в
стволе и капилляре, qC(bЗС) – кровоток в стволе в золотом режиме
гипертензии; lK=lK(bЗС)/lC(bЗС)>1, mK=xK(bЗС)/xC(bЗС)<1 – соответственно коэффициенты
перехода от ствола к капилляру по длине и вязкости крови. При известных
значениях xC(bЗС)=1,45×10-2 Пз,
xK(bЗС)=1,15×10-2 Пз,
lC(bЗС)= 41,4 мкм и lK(bЗС) = 220 мкм величина mK=0,79 и lK=5,3. Расход механической мощности в
отдельной ветви (капилляре) для золотого режима гипертензии
WMK(bЗС) = 2,6WMC(bЗС). (5.2)
Таким образом, суммарная механическая мощность в ветвях
(капиллярах) приблизительно в 5,2 раза превосходит таковую в стволе (артериоле).
Химическая мощность в капилляре в золотом
режиме гипертензии
WXK(bЗС) = (p/4)bK(bЗС)dK(bЗС)2lK(bЗС).
Очевидно, что вследствие равенства aK(bЗС)=aC(bЗС),
lK(bЗС)/dK(bЗС)tK(bЗС) = lC(bЗС)/dC(bЗС)tC(bЗС).
Исходя из этого выражения и (5.1),
bK(bЗС) = μKbC(bЗС). (5.3)
С учетом этой поправки для одного капилляра
(ветви тройника),
WXK(bЗС) = mKlKWXС(bЗС) = 2,6WXС(bЗС). (5.4)
Из
сравнения (5.2) и (5.4) очевидна полная
аналогия изменений механической и химической мощностей в капиллярах. Расход
суммарной мощности в 2 ветвях (капиллярах) по отношению к стволу возрастает
приблизительно в 5,2 раза. Соответственно,
2WK(bЗС)/WС(bЗС) = 5,2. (5.5)
Таким
образом, в артериолярно-капиллярном тройнике
нарушается правило, общее и для
транспортных, и обменных тройников. В артерио-капиллярных тройниках
ветви по затратам энергии значительно превышают ствол. Однако выгода такова
превышения очевидна: препочтительнее тратить больше
энергии там, где «цена» потребляемого кислорода минимальна.
Определим доли механической и химической энергии в
суммарном расходе энергии в капилляре. В золотом режиме с учетом представленных
выше величин qK(bЗС), dK(bЗС), lK(bЗС) и ξK(bЗС) механическая мощность WМK(bЗС)=4,3×10-5 ×г×см2×с-5. Соответственно, с учетом известных
величин bK(bЗС), dK(bЗС) и lK(bЗС) химическая мощность WХK(bЗС)=8,56×10-
γK(bЗС)
= WМK(bЗС)/WХК(bЗС)
= 0,5.
Следует
отметить важную особенность затрат энергии в капилляре: отношения WМK(bЗС)/WK(bЗС)=0,334 и WXK(bЗС)/WK(bЗС)=0,666 аналогичны отношению чисел Фибоначчи (1:2).
Таким образом, для золотого режима гипертензии
получены два соотношения, оптимальные для каждого сердечного капилляра,
aK(bЗС) = 160 с-1,
(5.6)
gK(bЗС) = WМK(bЗС)/WХK(bЗС) = 0,5.
(5.7)
Величины
a(bЗС) и g(bЗС) аналогичны для каждой транспортной и обменной артерии, а также капилляра.
Этот феномен указывает на универсальность этих отношений для гармоничного
сопряжения множества структурных, гемодинамических и химических параметров в
каждом сердечном сосуде.
5.2.2 Артерио-капилярные
тройники в режимах гипертензии
В режимах гипертензии, отличных от покоя, коронарный
кровоток и количество открытых капилляров возрастают. Экспериментально
установлено, что при увеличении активности сердца
концентрация воды в сердечной ткани /Nachev, 1974/, температура крови и тканей
/Иванов, 1972/, размеры и внутренняя конфигурация капилляров /Tilton et al., 1979/ остаются без изменений. Тем самым
обеспечивается постоянство среды, окружающей
капилляры, и постоянство размеров последних независимо от уровня гипертензии.
При
гипертензии размеры капилляров и вязкость крови не изменяются,
dK(b) = dK(bЗС), (5.8)
lK(b) = lK(bЗС),
(5.9)
xK(b) = xK(bЗС), (5.10)
где
dK(bЗС), dK(b), lK(bЗС), lK(b), xK(bЗС), xK(b) – соответственно
диаметр, длина и вязкость крови в капилляре в золотом и других режимах
гипертензии.
Исходя из (5.8) – (5.10),
VK(b) = VK(bЗС), (5.11)
GK(b) = GK(bЗС), (5.12)
где VK(bЗС), VK(b), GK(bЗС), GK(b) – соответственно объем и проводимость капилляра в режимах
гипертензии.
Известно /Duling, Klitzman, 1980/, что существует линейная связь
между относительными изменениями давления в крупных артериях и микрососудах различных органов и тканей млекопитающих.
Следовательно, при увеличении среднего давления в крупных коронарных артериях в
b раз,
давление на капилляре
DPK(b) = bDPK(bЗС). (5.13),
Соответственно, исходя из (5.11)–(5.13),
qK(b) = bqK(bЗС), (5.14),
tK(b) = tK(bЗС)/b, (5.15),
где
qK(b), tK(b)
–кровоток и время пребывания эрироцитов в капилляре в
режимах гипертензии.
В золотом режиме гипертензии связь гемодинамических и
конструктивных параметров капилляра может быть представлена выражением
DPK(bЗС)tK(bЗС) = 32xK(bЗС)[(lK(bЗС)/dK(bЗС)]2. (5.16)
В режимах гипертензии, исходя из (5.8)–(5.15),
bDPK(bЗС)tK(bЗС)/b = 32xK(bЗС)[(lK(bЗС)/dK(bЗС)]2. (5.17)
В левой части этого закона представлены гемодинамические, а в
правой – конструктивные параметры капилляра и крови.
В условиях гипертензии механическая
мощность в капилляре
WMK(b) =
= b2WMK(bЗС). (5.18)
При гипертензии aK(b) = baK(bЗС)
bK(b) = b2bK(bЗС). (5.19)
Следовательно, химическая мощность
WXK(b) = b2WXK(bЗС). (5.20)
Исходя из (5.18) и (5.20) очевидно, что
gK(b) = WMK(b)/WXK(b) = WMK(bЗС)/WXK(bЗС) = 0,5. (5.21)
Закон (5.21) отражает оптимальную «энергетическую» конструкцию капилляра. Это отношение является
инвариантом оптимальной гармонии для всех сердечных артерий и капилляров покое
и при любой гипертензии.
В
заключение необходимо отметить элементы общности и различий в организации
транспортного, обменного и капиллярного русла сердечной мышцы. Транспортное
русло состоит из генераций тройников, в которых ветви в сумме «воспроизводят»
ствол как по затратам энергии, так и по объему крови и сосудистого материала. В
обменных тройниках ветви воспроизводят ствол только по затратам энергии.
Последняя генерация обменных тройников – артерио-капиллярная - представляет
собой своего рода переходную конструкцию: стволы этих тройников – прекапиллярные артериолы, а ветви
– капилляры. В этих тройниках нарушено энергетическое правило артериальных
тройников – суммарный расход энергии в ветвях (капиллярах) значительно выше,
чем в стволе (артериоле). Однако и в этих тройниках
сохранено важнейшее общее свойство оптимизации - аналогичное оптимальное
соотношение затрат механической и химической энергии во всех звеньях
артерио-капиллярных тройников. В итоге можно сказать, что всем тройникам
артерио-капиллярного русла во всех режимах гипертензии независимо от их калибра
и назначения присущи два энергооптимальных
инварианта,
[k(b)H1(b)]3/2 + [k(b)H2(b)]3/2 = 1, (5.22)
WM(b)/WX(b) = 0,5, (5.23)
где k(b), H1(b), H2(b) –
коэффициенты, характеризующие архитектонику тройников, WM(b)/WX(b) – отношение механической и химической мощностей,
расходуемых в сосудах в режимах гипертензии. Законами (5.22) и (5.23)
представлена энергооптимальная гармония «вхождения» параметров с систему
«Артерио-капиллярный тройник».
5.3. Особенности кислородного обеспечения миокарда
Первую модель кислородного снабжения
тканей («тканевой цилиндр») разработали в 20-х годах прошлого столетия датский
физиолог А. Крог и математик Эрланг. Они рассчитали
величины рО2 в тканях на разных расстояниях от капилляра. В основу
расчетов были положены известные для того времени величины коэффициентов
диффузии в тканях, рО2 в капиллярах и среднего расстояния между
капиллярами. В простейшем виде эта формула выглядит следующим образом
pO2=AR2K1/D,
где pO2 – величина напряжения кислорода в ткани на расстоянии R от стенки капилляра; А – потребление
кислорода в определенных единицах; D - коэффициент диффузии; K1 - некоторая постоянная величина. Это выражение отражает изменения
рО2 на различных расстояниях от стенки капилляра (радиус капилляра
принимается постоянным). Формула Крога-Эрланга
впервые поставила изучение диффузии кислорода в тканях на количественную
основу. С ее помощью удалось получить представление о границах объема ткани,
снабжаемой кислородом из ближайшего капилляра, а также выяснить роль величины
потребления кислорода тканями и коэффициента диффузии. В этом заключается
принципиальная заслуга авторов таких расчетов. Однако эта формула и модель А. Крога в виде
тканевого цилиндра не представляла никаких сведений об истинном напряжении
кислорода в сложной капиллярной сети сердца, мозга, мышц и других органов.
Попытки усовершенствовать расчеты без принципиальных изменений привели к
возникновению искусственных понятий, вроде «мертвого угла» на венозном конце
капилляра /Grote, Thews, 1962/. Однако модель А. Крога прочно вошла в научный обиход. В 50-х и 60-х г.г.
многие исследователи пытались анализировать экспериментальные данные и
объяснять феноменологию транспорта кислорода в тканях с помощью этого
упрощенного метода. /Opitz, Schneider, 1950; Thews, 1953, 1960; Diemer, 1965; Иванов, 1968 и др./. Его
неоправданное применение продолжалось и в последующие годы /Weibel, 1984/.
Однако еще в 60-е годы прошлого столетия
стало ясно, что реальная картина распределения величин рО2 в разных
точках тканей между сосудами может быть получена только при расчетах в 3-х
координатном пространстве, т.е. в реальном пространстве тканей. Первый решающий
шаг в этом направлении сделал Грюневальд /Grunewald,
1968/. Его модель представляла собой объем ткани в виде параллепипеда,
у которого капилляры являются продольными ребрами. Параллепипед
рассекался параллельными плоскостями, перпендикулярными к капиллярам. Для
расчета рО2 в модели принимались следующие условия: 1) распределение
кислорода рассматривается в пространстве, которое включает в себя ячейку
капиллярной сети в виде 4-х параллельных капилляров; 2) зависимость между
степенью насыщения крови кислородом и уровнем его напряжения в крови капилляра
определяется кривой диссоциации оксигемоглобина; 3) транспорт кислорода из
капилляров в ткань осуществляется за счет диффузии по его концентрационному
градиенту, который пропорционален градиенту напряжений (скорость диффузии
кислорода во всем пространстве считается одинаковой, т.к. физические свойства
тканей во всем пространстве между капиллярами принимаются одинаковыми). В этой
модели для описания распределения рО2 в тканях, окружающих один
капилляр, использовалось уравнение
dU/dt + m/α = DΔU,
где U – напряжение кислорода в ткани; D - коэффициент диффузии кислорода; α - коэффициент растворимости кислорода; m - потребление кислорода единичным объемом
ткани за единицу времени, t - время; Δ - оператор Лапласа. Распределение рО2 во всем объеме
тканей модели для стационарного случая определяется из уравнения
DU(х,y,z) = m(x,y,z)/Da,
где x, y, z – пространственные координаты.
В математических исследованиях все чаще
используют модель У. Грюневальда. Это позволило провести ряд интересных математических
экспериментов и обнаружить важные закономерности /Grunewald, Sowa, 1978;
Иванов, Лябах, 1979, 1980; Popel, 1989/. Однако модель Грюневальда
имеет существенные недостатки. В этой модели капилляры предстают некими
«безликими» трубками без диаметра и длины. Принимается, что капилляры имеют
форму круговых цилиндров, но и это никоим образом не учитывается при расчетах.
Не принимаются во внимание параметры крови в капилляре (гематокрит, вязкость,
форма эритроцитов), а также линейная скорость движения эритроцитов и скорость
диффузии из них кислорода. Совершенно не принимаются в расчет особенности
«капиллярного» участка кривой дезоксигенации
гемоглобина, а также условия, связанные со структурной организацией кардиомиоцитов. В представленном нами ниже системном
исследовании эти «забытые» параметры учитываются. Более того, показана важнейшая
роль этих, не учитываемых ранее, параметров в организации оптимального
кислородного обеспечения сердечной мышцы.
Диффузия кислорода, несмотря на разницу в его
потреблении в различных регионах сердца, происходит в одинаковых условиях.
Условия поступления кислорода в сердечную ткань млекопитающих обусловлены
следующими постоянными аспектами:
1. Кровь млекопитающих независимо от их
массы имеет полное насыщение кислородом
/Шмидт-Нильсен, 1987/.
2. Коэффициент диффузии кислорода в ткань
в основном определяется концентрацией воды в органе /Vaupel, 1976/ и в значительной степени его
температурой /Гительзон и др., 1977/. Концентрация
воды в сердечной ткани постоянна по всему объему сердца /Yipintsoi et al.,
1972/, а разница температур для различных слоев сердечной мышцы не превышает
0,5оС /Engelking, Bienroth,
1959/. Следовательно, коэффициент диффузии кислорода практически постоянен по
всему объему сердца.
3. Коэффициент растворимости кислорода в
сердечной ткани в умеренной степени зависит от температуры /Grote, Thews, 1962/.
.Температура во всех регионах сердца различается незначительно, следовательно,
коэффициент растворимости кислорода – постоянная величина по всему объему
сердца.
4. Величина гематокрита, определенная
путем центрифугирования порции крови из микрососудов и капилляров, практически
не отличается от гематокрита крови из транспортных и обменных сосудов /Klitzman, Duling, 1979/.
Это означает, что гематокрит единичного объема крови, движущегося через микрососуды, постоянен и не зависит от их диаметра.
5. Отношение поверхности миоцитов и капилляров по всему объему левого желудочка
равно постоянной величине /Автандилов, Геворкян,
1980/
6. Размеры эритроцитов различных видов
млекопитающих практически одинаковы /Altman, Ditter, 1961/.
7. Произведение величины площади
поверхности эритроцита на их число в единичном объеме крови млекопитающих –
величина постоянная /Чижевский, 1959/.
8. Концентрация гемоглобина в крови
различных видов млекопитающих практически одинакова /Шмидт-Нильсен,
1987/.
9. Величина среднего напряжения кислорода
рО2 во всех регионах сердца одинакова /Henquell L., Honig C.R., 1976; Honig, Gayeski, 1987/.
Таким образом, имеет место неизменность
перечисленных выше параметров по всему объему сердца в течение всего сердечного
цикла. Сохраняется во времени и пространстве постоянство аспектов организации
капиллярного русла в миокарде: неизменность
размеров, параллельность мышечному волокну и асимметричное расположение
артериальных и венозных концов. В то же время абсолютные значения кровотоков и
утилизация кислорода одномоментно могут значительно
различаться в отдельных регионах сердца (например, в верхушке и основании,
эндокарде и эпикарде) /Джавахишвили, Комахидзе, 1967; Feldstein et al., 1978/. Значительны расхождения по
величине этих параметров и в отдельные моменты кардиоцикла.
Следует отметить, однако, что одномоментно по объему
сердца большему потреблению кислорода в отдельных регионах соответствует и
больший кровоток, и большее количество открытых капилляров. Следовательно,
качественная картина распределения этих параметров во времени и пространстве
всюду совпадает. Экспериментально установлено, что для сердца распределение
величин кровотока /Sestier et
al., 1978/, потребления кислорода /Grunewald, Sowa, 1978/,
расстояний между открытыми капиллярами /Feldstein et al., 1978/ и тканевого
напряжения кислорода /Wahlen et al., 1973/ имеет нормальный характер.
С помощью соответствующих
расчетов, учитывая нормальный закон распределения этих параметров и постоянство
других, можно представить капиллярную сеть как усредненную, равномерно
распределенную по миокарду с совершенно одинаковыми условиями движения крови и
отдачи кислорода. Наиболее удобной ячейкой для анализа условий доставки
кислорода в клетки является объем сердечной ткани, перфузируемый
4 капиллярами. По форме эта ячейка соответствует взаимному расположению
мышечных волокон и капилляров, принятому в модели Грюневальда
(рис. 5.1). Усредненное распределение открытых капилляров представляет собой
квадратную решетку, в каждую ячейку которой
включено мышечное волокно (рис. 5.2). Объем ткани,
обеспечиваемый четырьмя открытыми капиллярами, имеет форму прямой призмы с
капиллярами в качестве боковых ребер (рис. 5.1). Эта ячейка в дальнейшем будет
использована нами для исследования распределения величины рО2
по объему призмы. Кислородный «комфорт» миокарда в покое и при любом уровне
гипертензии должен соответствовать следующим условиям:

1) кислород должен поступать в клетки в количестве,
соответствующем уровню их метаболизма (кислородноеобеспечение
«по количеству»);

2) напряжение кислорода, поступающего в клетки, должно
превышать
критическую для данного уровня метатаболизма
величину рО2, ниже
которой начинается гибель клеток (кислородное обеспечение «по качеству»).
5.4. Сопряжение формы капилляра с кривой дезоксигенации гемоглобина
Несомненно, что S-образная форма кривой диссоциации оксигемоглобина
имеет важное биологическое значение. Если бы кривые диссоциации имели форму прямоугольной
гиперболы, то при переходе к низким значениям рО2 происходила бы
моментальная отдача кислорода в виде «взрыва». Кривые же S-образной формы обеспечивают диссоциацию
оксигемоглобина не в форме «взрыва», а в виде постепенной и плавной отдачи кислорода
в окружающие ткани (см. раздел 4.5).
Гемоглобин крови различных видов млекопитающих идентичен в отношении связывания
кислорода одинаковым количеством гемоглобина (
Кривая оксигенации
гемоглобина HbO2=f(рО2)
представлена на рис. 4.4. Кривая соответствует естественным параметрам крови: рН 7,40, рСО2=39,7 мм рт.
ст. и t=37оС
/Уайт и др., 1981/. По мере продвижения эритроцита по цепочке обменных
микрососудов непрерывно возрастает разность между значениями HbO2=97% и рО2=95 мм рт. ст. в аорте и их значениями в каждом обменном микрососуде. На основе кривой HbO2= f(рО2)
нами была построена разностная кривая DрО2=f(DHbO2) (рис. 5.3) /Цветков, 1986/. В
результате такого построения получилась система координат, в которой HbO2 и рО2
поменялись местами, а кривая HbO2=f(рО2) по принципу «из конца в начало»
преобразована в кривую DрО2=f(DHbO2). При
построении этой кривой за начало отсчета была принята точка с координатами HbO2=97% и рО2=95
мм рт. ст. на кривой HbO2=f(рО2). Разностная кривая удобна для анализа
закономерностей «разряда» эритроцита в капилляре.
Произведенный нами анализ показал, что в пределах
ΔHbO2 =5,5-68,6% и ΔpO2=30-
[k(b)H1(b)]3/2 + [k(b)H2(b)]3/2 = 1, (5.24)
Всякой разности двух значений ΔHbO2 на
логарифмическом участке соответствует величина разности напряжения кислорода
dpO2= ΔрО2(ΔHbO2*)-ΔрО2(ΔHbO2^) = 42lg(ΔHbO2*/ΔHbO2^), (5.25)
где ΔHbO2* , ΔHbO2^ - значения
ΔHbO2 на логарифмическом участке разностной кривой в пределах
5,5% £ ΔHbO2 £ 68,6%.
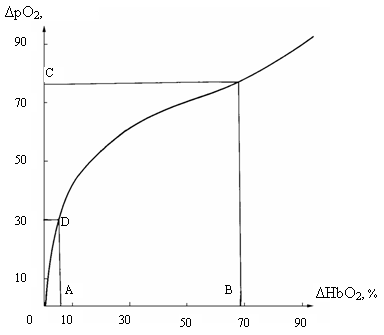
Рис. 5.3. Разностная кривая дезоксигенации
гемоглобина человека /Цветков, 1986/ По оси абсцисс ΔHbO2. в %, по оси координат
ΔpO2 в мм рт. ст. Интервалы AB и CD соответствуют логарифмическому
участку кривой, где ΔpO2=42lgΔHbO2. Интервал АВ
- ΔHbO2=5,5-68,6%; интервал CD ΔpO2-=30-
На кривой диссоциации гемоглобина в ее
обычном представлении (см. рис. 4.4) логарифмическому» диапазону ΔpO2=30-
Очевидно, что если в выражении (5.25)
величины ΔHbO2* и ΔHbO2^ уменьшать в одинаковое
число раз, оставаясь при этом в пределах логарифмического участка, то величина
соответствующей им разности dрО2 остается неизменной. В
условиях гипертензии рост среднего аортального давления в b раз вызывает уменьшение разности
концентраций кислорода на участках аорта - артериальный конец капилляра и аорта
- венозный конец капилляра в b раз. Легко показать, что это равнозначно
уменьшению артерио-венозной разности насыщения на капилляре в b раз /Цветков, 1986, 1993/,
a-vHbO2K(b) =
a-vHbO2K(bЗС)/b, (5.26)
где a-vHbO2K(bЗС), a-vHbO2K(b) -
артерио-венозная разность в крови капилляра в золотом и некотором режиме
гипертензии. С учетом (5.24)–(5.26), при гипертензии напряжение кислорода на
концах капилляра возрастает на одну и ту же величину δpO2(b)=42lgb
/Цветков, 1986, 1993/.
Следовательно,
apO2(b) = 50
+ 42lgb, (5.27)
vpO2(b) = 20
+ 42lgb, (5.28)
где apO2(b), vpO2(b) - соответственно напряжение кислорода на
артериальном и венозном концах капилляра в режиме гипертензии. В выражениях
(5.27)-(5.28) представлена картина обеспечения «качественных» изменений
кислорода в капилляре в режимах гипертензии.
Максимальной гипертензии (b=2) соответствует приращение δpO2=12,6
мм рт. ст. Эта величина соответствует двойному
возрастанию скорости эритроцитов в капилляре. Интересно отметить, что
аналогичное приращение (δpO2=10 мм рт.
ст.) в различных точках нейрона мозга получено на модели Грюневальда
также при двукратном увеличении скорости эритроцитов в капиллярах /Иванов, Кисляков, 1979/. Очевидно, что и при
максимальном приращении величина aрО2(b) не выходит за верхний
предел логарифмического участка кривой насыщения гемоглобина (
a-vpO2K(b) = const.
(5.29)
Эта константа гарантирует минимально возможную разность величин рО2
на концах капилляра при любой гипертензии, что обеспечивает минимальный разброс
величин рО2 по объему призмы (см. раздел 5.5). Закон (5.29) является
кислородным инвариантом, обеспечивающим «качество» кислорода, диффундируемого в кардиомиоциты.
Необходимо отметить еще одну особенность
адекватного кислородного обеспечения по «качеству» в условиях гипертензии. Как
было представлено в параграфе 3.3.3, каждый уровень гипертензии «окрашивает»
свою часть открытых артериол и капилляров в соответствующий «цвет». В обменных генерациях размеры
сосудов остаются постоянными при любой гипертензии. При некотором уровне
гипертензии давление, приложенное к любому сосуду данной генерации одинаково и
не зависит от его «окраски». Скорость отдачи кислорода из каждого поперечного
сечения микрососудов, включая и капилляры, постоянна и равна 220% с-1
(см. раздел 4.5). Соблюдение этих закономерностей для всех обменных генераций
означает, что в каждой генерации эритроциты входят и выходят из всех сосудов
со «своими» одинаковыми значениями рО2.
Естественно, что одинаковы рО2 также на входе и выходе для всех
капилляров. Этот феномен обеспечивает одинаковые условия диффузии кислорода
из всех капилляров. Отметим еще одно очень важное обстоятельство. Эритроцит
при движении в любом сечении капилляра отдает кислород с постоянной скоростью.
Представим, что эритроцит перемещается по капилляру равномерно. В этом случае
величина изменения насыщения гемоглобина на каждом единичном отрезке капилляра
(ΔHbO2/ΔlK) была бы постоянной. В то же время «падение» величины
рО2 на каждом единичном отрезке (ΔpO2/ΔlK), исходя
из формы кривой насыщения (рис. 4.4), уменьшалось бы
по направлению от артериального к венозному концу капилляра. Такое изменение
ΔpO2 будет происходить из условия: капилляр - прямой
круговой цилиндр. Фактически же капилляр можно
представить как круговой усеченный конус, поскольку его диаметр по длине не
постоянен и на венозном конце больше, чем на артериальном, на 1-2 мкм /Zweifach,
1971/. Эритроцит движется от начала капилляра к концу с замедлением. За счет
этого время пребывания на венозных сегментах по сравнению с артериальными
возрастает в 1,4-1,8 раза. С учетом этой неравномерности получается обратная
картина - отношение ΔHbO2/ΔlK по направлению к венозному концу
возрастает, а отношение ΔpO2K/ΔlK остается
приблизительно постоянным, т.е. происходит равномерное, линейное
изменение рО2 по всей длине капилляра. Нелинейный логарифмический
сегмент кривой как бы «распрямляется» на капилляре (см. рис. 5.4).
Соотношение между внутренней поверхностью капилляра SK и внешней суммарной поверхностью SSЭ
эритроцитов, проходящих мимо этой внутренней поверхности, имеет ведущее
значение в явлениях метаболизма. По расчетам, представленным А.Л.Чижевским
/Чижевский, 1959/, это соотношение убывает от крупных сосудов к капиллярам. В капиллярах
отношение SSЭ/SK=1,26@![]() , т.е. связано с золотым числом 1,618. Этот феномен
означает, что наибольший уровень метаболизма имеет место в капиллярах. Отдает ли при этом кровь на каж-
, т.е. связано с золотым числом 1,618. Этот феномен
означает, что наибольший уровень метаболизма имеет место в капиллярах. Отдает ли при этом кровь на каж-
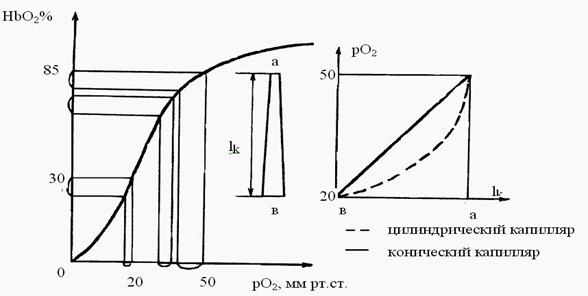
Рис. 5.4. «Распрямление»
кривой дезоксигенации гемоглобина HbО2=f(pO2)
на капилляре.lk – длина капилляра, а, в артериальный и венозный концы
капилляра.
дой
единице длины капилляра одно и то же количество кислорода? Покажем, что такое
равенство существует. Отдельный эритроцит проскакивает узкие сегменты капилляра
быстрее, чем широкие. Поскольку эритроцит отдает кислород с постоянной
скоростью, то на узком единичном сегменте он отдает кислорода меньше, чем на
широком. Однако это различие устраняется тем, что общее количество эритроцитов,
проходящих через узкий сегмент за единицу времени больше, чем в широком.
Вследствие этих обратно пропорциональных изменений каждый единичный сегмент
капилляра за единицу времени отдает одинаковое количество кислорода. Таким
образом, вследствие особенностей формы капилляров и кривой насыщения гемоглобина
обеспечивается: 1) линейное изменение величины рО2 по длине
капилляра, 2) диффузия одинакового количества кислорода на каждой единице длины
микрососуда. В основе этих феноменов лежит
гармония оптимального сопряжения формы, диаметра и длины капилляра и S-образной формы кривой оксигенации
гемоглобина. Можно сказать, что на
уровне отдельного капилляра имеет место энергооптимальное
«вхождение» архитектонических, гемодинамических и кислородных параметров в
систему «Капилляр».
5.5. Распределение рО2 в капиллярно-тканевыx призмах
в режимах гипертензии
Сердечные капилляры параллельны друг другу и мышечному
волокну, которое они обеспечивают кислородом.
Установлено /Reeves,
Rakusan, 1988/, что в миокарде кровотоки в соседних капиллярах в
преобладающей степени противоположны. Представим взаимное расположение
капилляров и мышечного волокна в виде прямой призмы, построенной на квадратном
основании, с четырьмя перфузируемыми капиллярами в
качестве ребер (мышечное волокно проходит внутри призмы) (рис. 5.2). Потребление
кислорода сердечной мышцей в течение систолы и диастолы резко различается: от
общего количества в систолу потребляется 91%, а в диастолу – только 9% /Monroe, 1964/. Форма призм, соответствующих
систоле и диастоле, отличаются друг от друга лишь расстояниями между ребрами
(капиллярами). Существует полная «кислородная» аналогия между «систолической» и
«диастолической» призмами. Это подобие очевидно из
следующих экспериментальных данных. В любой момент кардиоцикла
распределение величин рО2 в крови сердечных капилляров /Schmidt et al., 1964/, в отдельном кардиомиоците
/Whalen, 1971/ и
сердечной ткани /Breull et al., 1981/ постоянно. Величина среднего
напряжения кислорода рО2 во всех регионах сердца в течение кардиоцикла также одинакова /Henquell L., Honig C.R., 1976; Honig, Gayeski, 1987/. Исходя из этих обстоятельств,
очевидно, что отношение расстояний между капиллярами в «систолической» и «диастолической» призмах обратно пропорционально отношению
потребления кислорода единичным объемом сердечной мышцы за систолу и диастолу,
dS(βЗС)/dD(βЗС) = ![]() ,
,
где
dS(βЗС), dD(βЗС) ВS(βЗС), ВD(βЗС) –
соответственно расстояние между капиллярами и потребление кислорода единичным
объемом ткани за систолу и диастолу в золотом режиме гипертензии. Очевидно, что
произведение объема систолической призмы на скорость потребления кислорода
единичным объемом призмы равно аналогичному «диастолическому»
произведению. Эта аналогия имеет место в каждом регионе сердечной мышцы в
любой момент кардиоцикла. Поэтому в дальнейшем
можно ограничиться анализом кислородных параметров систолической или диастолической призмы.
Капиллярное русло миокарда состоит из обменных (d=5-7 мкм) и магистральных капилляров (диаметр до 20
мкм). Исходя из большой разницы потребления кислорода в течение сердечного
цикла, следует считать, что в течение диастолы обменных капилляров
задействовано в 10 раз меньше, чем в систолу. Очевидно, что большая часть
коронарного кровотока во время диастолы протекает через магистральные сосуды.
Отметим в связи с этим, что выделение аденозина и его
производных в течение диастолы значительно ниже, чем
в систолу /Thompson et al.,
1980/, что, по-видимому, связано с перераспределением кровотока между обменными
и магистральными капиллярами. Магистральные капилляры, соединяющие артериолы и венулы, не являются
фиксированными структурами микроциркуляторного русла, а временно возникают на
том или ином участке, выполняя роль шлюзов, открывающих путь для прямого
перехода артериальной крови в венозный отдел системы /Куприянов и др., 1975/.
Эти капилляры аналогичны обменным, однако имеют больший диаметр и меньшую длину; кровь в них движется в 2-3
раза быстрее. Магистральные капилляры функционируют как шунты между артериолами и венулами, в них не
происходит полный диффузионный обмен между кровью и тканями.
Рассмотрим преобразование призмы, соответствующей
одной из фаз кардиоцикла (например, систоле), в
режимах гипертензии (рис. 5.5).
Рис. 5.5. Капиллярно-тканевая призма. А – в золотом, Б –в режиме
гипертензии. lK(βЗС), lK((β) - длина капилляра в золотом и некотором режиме
гипертензии, lK((β)=lK(βЗС); đ(βЗС), đ(β) - расстояние между капиллярами в золотом и других режимах
гипертензии, đ(β)=đ(βЗС)/![]()

При заданном уровне гипертензии призма А
(золотой режим гипертензии) превращается в призму Б. В этой призме потребление
кислорода единичным объемом призмы за единицу времени возрастает в β раз /Цветков, 1993/, а
расстояние между ребрами уменьшается в ![]() раз. Очевидно, что
потребление кислорода объемами систолических призм А и Б за единицу времени
одинаково; та же аналогия потребления кислорода имеет место и для диастолических призм А и Б. Таким образом, при росте
гипертензии возникает последовательность равнопотребляющих
кислород призм А, Б1, Б2, Б3 и т.д. (индексы
1, 2, 3 соответствуют гипертензии β1,
β2, β3).
раз. Очевидно, что
потребление кислорода объемами систолических призм А и Б за единицу времени
одинаково; та же аналогия потребления кислорода имеет место и для диастолических призм А и Б. Таким образом, при росте
гипертензии возникает последовательность равнопотребляющих
кислород призм А, Б1, Б2, Б3 и т.д. (индексы
1, 2, 3 соответствуют гипертензии β1,
β2, β3).
Представим, что при гипертензии величины рО2
на артериальном и венозном концах капилляров в этих призмах остаются
неизменными и равными их значениям в золотом режиме. Очевидно, что в этом
случае распределение величин рО2 в сечениях призм, равноудаленных от
основания, оставалось бы одинаковым и равным распределению в золотом режиме. В
действительности же при росте гипертензии величина рО2 на концах всех капилляров призмы в соответствии с выражениями (5.27)
и (5.28) возрастает. Вследствие этого величина рО2 в
сердечной ткани должна возрастать, что имеет экспериментальное подтверждение /Саноцкая, 1968; Schuchhardt,
1973/.
Велико значение пространственной асимметрии цепочек
капилляров и логарифмичности «капиллярного» участка
кривой насыщения для обеспечения одинакового «качества» потребляемого кислорода
во всех сечениях призмы. Равномерность обеспечения «качества» кислорода
(распределение рО2) по сечениям призмы связана со следующими
особенности пространственного расположения капилляров. Четыре капилляра по
ребрам призмы расположены таким образом, что: 1) кровотоки в противоположных
капиллярах имеют обратные направления; 2) концы соседних капилляров по
отношению к одному из ребер смещены соответственно на полдлины вверх и вниз.
Как мы уже показали выше, за счет замедленного движения эритроцита в капилляре
распределение рО2 по длине капилляра имеет линейный характер. За
счет этого феномена обеспечивается равномерное линейное распределение рО2
по длине каждого из 4 капилляров (рис. 5.2). При
переходе от одного сечения к другому приращения величины рО2
в парах противоположных капилляров одинаковы, но обратны
по знаку, т.е. происходит взаимная компенсация изменений рО2 в
плоскости сечения. Таким образом, распределение рО2 во всех
сечениях изменяется незначительно, т.е. практически одинаково.

Покажем повторяемость, симметрийность распределения величин рО2 по
длине мышечного волокна в золотом режиме гипертензии. На протяжении мышечного
волокна существует некоторая последовательность капиллярно-тканевых призм.
Выберем в качестве исходного сечение некоторой призмы на уровне,
соответствующем артериальному и венозному концам двух противоположных
капилляров (рис. 5.6). Если «сместиться»
от этого сечения вниз на полдлины капилляра, то исходное распределение рО2
в данном сечении «поворачивается» на 90° относительно продольной оси волокна.. При последующих
смещениях на полдлины капилляра исходное распределение поворачивается
соответственно на 180о, 270о и 360о. При 360о,
т.е. при смещении на 2 длины капилляра, распределение рО2 имеет
пространственное положение, совпадающее
с исходным. При дальнейшем смещении через каждые 2lk цикл «поворота» снова повторяется. Очевидно, что и
при смещениях, промежуточных между рассмотренными, будет происходить поворот
исходного распределения на некоторые углы в пределах 0o<y<90o, 90o<y<180o,
180o<y<270o, 270o<y<360o;
эти распределения будут повторяться при смещении по длине через каждые 2lk. Таким образом, распределение рО2 вдоль
мышечного волокна происходит в соответствии с винтовой симметрией. Такое
пространственное сопряжение капилляров и мышечного волокна обеспечивает одинаковые
условия для «качественного» кислородного обеспечения мышечного волокна по всей
его длине. Благодаря этому обстоятельству ни один из кардиомиоцитов
в золотом режиме гипертензии не находится в менее благоприятных условиях, чем
остальные.
Произведем анализ распределения рО2 в
условиях гипертензии. Выберем для сравнения некоторое k-сечение призм А (покой)
и Б (гипертензия), равноудаленное от основания (см. рис.
5.2 и 5.5). Распределение рО2 в k-сечении призмы А (золотой режим
гипертензии) соответствует некоторой кривой I (рис. 5.7).
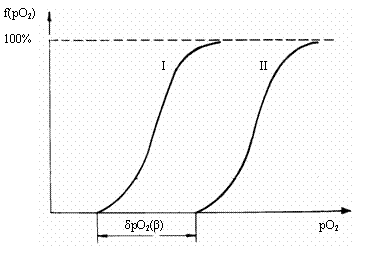
Рис. 5.7. Плотность распределения величин рО2
в k–сечении капиллярно-тканевой призмы. По оси абсцисс
– рО2 (условные единицы); по оси ординат – долевое распределение рО2
в k-сечении призмы (в %). I – распределение рО2 в золотом, II –
распределение рО2 в некотором режиме гипертензии; δpO2(β)=42lgβ – приращение рО2 на концах
капилляра в некотором режиме гипертензии
Напомним, что потребление кислорода в
обоих k-сечениях одинаково.
Поскольку во всех сечениях капилляров призмы Б напряжение кислорода возрастает
на величину dpO2=42lgβ то кривая плотности в
этом сечении смещается вправо на ту же величину (кривая II, рис. 5.7). Естественно, что аналогичное
смещение распределения рО2 просходит во всех других сечениях призмы Б. При этом
сохраняется «винтообразное» распределение рО2 по длине мышечного
волокна, установленное нами выше для золотого режима гипертензии. Этот механизм
обеспечивает по всей длине мышечного волокна «качество» кислорода, адекватное
для заданного уровня гипертензии. С физиологической точки зрения сдвиг кривых
распределения вправо имеет важнейшее значение. В кардиомиоцитах
млекопитающих в среднем рО2 =3,4-
Экспериментально установлено /Mochizuki,
1966/, что скорость отдачи кислорода эритроцитом линейно зависит от разности рО2
в эритроците и потребляющей среде. Поскольку в каждом сечении приращения dpO2(β)
одинаковы и в капиллярах и в ткани, то,
как следствие этого, постоянна и скорость отдачи кислорода движущимся
эритроцитом. Эта скорость неизменна по всей длине сердечного капилляра в любой
момент кардиоцикла в покое и при любой гипертензии.
Она имеет, как было показано в 4 главе (раздел 4.5),
максимально возможное значение
U(β) = 220%/c.
Эта
величина является инвариантом всего обменного русла сердца. Смысл его заключается в том, что любое сечение
микрососудов во всякий момент времени независимо от уровня гипертензии отдает
кислород с постоянной, максимально возможной скоростью.
Таким образом, на примере тканевой призмы с
ребрами-капиллярами нами проанализированы оба механизма кислородного
обеспечения клеток - по «количеству» и «качеству». Эти механизмы взаимосвязаны
друг с другом. Первый механизм в условиях гипертензии обеспечивается
увеличением плотности капиллярной сети в β раз,
а второй - возрастанием линейной скорости эритроцитов в капиллярах также в β раз. Как следствие этого, общий кровоток в
капиллярной сети увеличивается в β2 раз. Оба механизма
рефлекторно связаны с увеличением среднего аортального давления и потребления
кислорода миокардом в β раз. Наличие этих
факторов, а также логарифмичность участка на
разностной кривой, взаимная пространственная асимметрия соседних капилляров,
позволяет обеспечить адекватное снабжение кислородом каждого региона
миокарда по «качеству» и «количеству» как в покое, так и при любом
уровне гипертензии.
В заключение следует отметить инварианты, присущие
капиллярно-тканевым призмам в течение сердечного цикла при любом уровне
гипертензии:
1. постоянство
скорости отдачи кислорода из каждого капилляра;
2. постоянство
разности рО2 на артериальном и венозном концах капилляров;
3. постоянство
потребления кислорода объемом призмы за единицу времени;
4. постоянство
«винтового» распределения рО2 вдоль мышечного волокна.
Наряду с инвариантами, представленными в (5.22) и (5.23) для «гемодинамической» цепочки,
эти кислородные инварианты составляют оптимальную основу организации
«диффузионной» цепочки капилляров. Гармония энергооптимального
вхождения всех архитектонических, гемодинамических и кислородных параметров в
систему «Капиллярно-тканевая призма» обеспечивает ее адекватное обеспечение по
«количеству» и «качеству» с минимальными затратами энергии, крови и сосудистого
материала во всех режимах гипертензии.
Выше нами были рассмотрены полностью «капиллярные»
призмы (все ребра - капилляры). Рассмотрим призму, у которой одним из ребер
является артериола. В сущности, как поставщики
кислорода обменные артериолы почти ничем не
отличается от капилляров. Отметим ряд факторов архитектоники и гемодинамики,
аналогичных для артериол и капилляров. Стенки
мельчайших артериол имеют строение, весьма сходное со
строением капилляров: эпителий, тончайшая базальная мембрана и сравнительно
редкие и очень тонкие пучки гладких мышц. Все эти образования имеют такой же
коэффициент диффузии для О2 и СО2,
как и окружающие ткани /Иванов, 2001, т. 3, с. 182/. Обменные артериолы, также как и капилляры, параллельны мышечному
волокну, которое они обеспечивают кислородом /Hort, 1955/. Эритроциты при перемещении в артериолах с диаметром менее 40 мкм так же, как и в
капиллярах, имеют парашютообразную форму /Skalak, Branemark,
1969/, которая обеспечивает оптимальные условия для отдачи кислорода /Mochizuki, Kagawa, 1973/. В артериолах,
как и в капиллярах, отношение скоростей движения эритроцитов и плазмы
приблизительно равно 1,6 /Barnard et al., 1968; Klitzman, Duling, 1979/. Как нами показано выше, каждое
сечение артериол независимо от их диаметра отдает то
же количество кислорода, что и сечение в капилляре. Обьем
отданного кислорода той или иной артериолой за
единицу времени зависит лишь от ее длины, но не от диаметра. Таким образом,
«включение» артериол вместо капилляров ничего не
меняет за исключением одного обстоятельства – величины рО2 на концах
артериол значительно больше, чем на концах
капилляров. Однако и это различие нивелируется по мере удаления от стенки
сосудов. Показано /Duling et al., 1979/, что чем больше диаметр артериол, тем менее они проницаемы для кислорода, тем
больше падение рО2 на стенке.
У капилляров при небольшом удалении от стенки сосуда снижение тканевого рО2
сравнительно невелико. В то же время при таком же удалении от стенки артериол величина рО2 резко снижается, почти
достигая «капиллярных» значений /Иванов, Вовенко, 1986/. При
дальнейшем удалении от стенки снижение рО2 по аналогии с капиллярами
имеет пологий характер. Следовательно, «вставка» артериолы
вместо капилляра в плане адекватного обеспечения кислородом по «качеству» и «количеству»
практически ничего не меняет – распределение рО2 в любом сечении
призм во всех режимах гипертензии сохраняется таким же, что и при «капиллярном»
варианте. Однако между артериолами и капиллярами
есть существенное различие. Разница состоит в «цене» кислорода. Энергетическая
«стоимость» единичного объема кислорода, потребляемого из артериол, значительно выше, чем в капилляре (см. раздел 5.6). Отметим кстати, что дыхательный коэффициент
сердца (отношение объема потребленного кислорода к выделенному объему
углекислого газа) в покое и при гипертензии равен постоянной величине /Regan et al., 1961/.
5.6. «Цена» потребляемого кислорода в режимах
гипертензии
Произведем расчет «цены» транспорта единичного объема
кислорода через капиллярный участок в режимах гипертензии.
Кровоток и давление на уровне капиллярного русла любой
момент сердечного цикла равны постоянным величинам в. При гипертензии кровоток
через капиллярный участок по отношению к золотому режиму возрастает в β2
раз, а давление на капиллярах - в β раз /Цветков, 1993/. Средний расход мощности на перфузию
капилляров за сердечный цикл в некотором режиме гипертензии
WМK(β) = β3WМK(βЗС),
где
WМK(βЗС),
WМK(β)
- средняя за кардиоцикл механическая мощность в
генерации капилляров в золотом и некотором режимах гипертензии.
Поскольку объем капиллярного русла при гипертензии
возрастает в β раз, а
bK(β) = β2bK(βЗС),
то
WXK(β) = β3WXK(βЗC),
где
WXK(βЗС), WXK(β) - соответственно
средняя за сердечный цикл суммарная химическая мощность в генерации капилляров,
bK(βЗС), bK(β) - скорость расхода
химической энергии в единичном объеме капилляра в золотом и других режимах
гипертензии.
Естественно, что
WK(β) = β3WK(βЗС), (5.30)
где WK(βЗС), WK(βЗС) – общая мощность в капиллярном русле за единицу времени в
золотом и заданном режимах гипертензии.
Общий расход мощности в капиллярном русле
при гипертензии увеличивается в β3 раз, а средняя за
сердечный цикл скорость потребления кислорода сердечной мышцей возрастает в β2 раз /Цветков, 1993/.
Очевидно, что с ростом гипертензии «цена» единичного объема кислорода,
отдаваемого из капилляров за единицу времени, возрастает в β раз
ζK(β) = βζK(βЗС), (5.31)
где
ζK(βЗС), ζK(β) – энергетическая «цена»
единичного объема кислорода, потребляемого из капиллярного русла, в золотом и
других режимах гипертензии. Самый «дешевый» кислород в капиллярах имеет место в
золотом режиме гипертензии (β= βЗС=1), а наибольшая «цена» потребляемого
кислорода соответствует режиму максимальной гипертензии (βЗС=2).
Очевидно, что и для всех генераций обменных артериол
имеют место выражения, аналогичные (5.31).
Разница состоит, однако, в том, что чем дальше артериолы
от капилляров, тем выше «цена» потребляемого из них кислорода.
На капиллярном участке в сердечную мышцу поступает 85%
от всего кислорода, утилизированного миокардом, т.е. основная часть кислорода
поступает в ткани при наименьших затратах энергии. Покой (золотой режим
гипертензии) составляет наибольшую часть протяженности жизни животных. Таким
образом, кислородное обеспечение сердца млекопитающих в течение жизни в
основном осуществляется при самой минимальной энергетической «цене».
5.7. Капиллярная система теплообмена в
сердечной мышце
Кроме газообмена микроциркуляторная система имеет еще
одну важнейшую функцию - обеспечение теплообмена между тканями и кровью.
Теплообмен между тканями и кровью осуществляется в основном на капиллярном
участке кровеносного русла. Это явление обусловлено малой толщиной стенки
капилляра, огромной обменной поверхностью капиллярного участка, а также
максимальным по сравнению с другими микрососудами
отношением площади обменной поверхности к объему (S/V=4/d). Диаметр капилляра ограничен снизу величиной порядка
5-6 мкм. Дальнейшее уменьшение диаметра «нецелесообразно» из-за резкого
увеличения вязкости крови и гемолиза эритроцитов. Следовательно, теплообменная
поверхность капилляров имеет максимально возможную величину. «Расщепление»
одного крупного сосуда на несколько мелких, в сумме равных ему по объему,
позволяет получить не только значительно большую обменную поверхность, но и
создать условия для более равномерного отвода тепла, производимого в единичном
объеме сердечной ткани. «Подбор» минимального диаметра капилляров и
пространственное распределение капилляров позволяет избежать перегрева мышечных
клеток. Плотность капиллярной сети в миокарде «подобрана» природой такой, что
по всему объему сердца одновременно обеспечивается нормальный микрорельеф
температур и величин рО2.
Следует рассмотреть производство тепла в кардиомиоцитах. Энергия, производимая в клетках при
расщеплении глюкозы, расходуется на образование молекул аденозинтрифосфата
(АТФ) и рассевается в клетке в виде тепла; первая часть составляет порядка 40%,
а вторая – 60% от общего количества производимой энергии (эти величины
соотносятся как числа Фибоначчи 2:3). Отметим, что между утилизацией
кислорода и выделением тепла в сердечной мышце существует прямая линейная зависимость /Coulson, 1979/. При увеличении давления в аорте в
b раз потребление кислорода, образование
АТФ и выделение тепла из сердечных клеток возрастает в той же степени.
Аналогично в b раз возрастает плотность капиллярной сети
и количество единичных объемов крови, прошедших через капиллярное русло за
единицу времени. Следовательно, количество тепла, поступающее в единичный
объем капиллярной крови за единицу
времени, всегда будет постоянным независимо от степени гипертезии.
Благодаря этому постоянству температура крови на выходе из капилляров всегда
будет практически постоянной при всякой гипертензии, что имеет большое значение
для оптимального протекания в ней биопроцессов
метаболизма.
Температура сердечной ткани при
гипертензии за счет повышенного отвода тепла поддерживается приблизительно на
одном и том же уровне, что чрезвычайно важно, поскольку температура внутренних
тканей и органов млекопитающих колеблется в узкой биокинетической
зоне – 37,4±0,4°С /Иванов, 1972; Гительзон
и др., 1977/. Имеются по крайней мере два важнейших фактора, которыми можно
объяснить эту особенность жизни. Первый фактор состоит в том, что специфические
высшие структуры белков, которые определяют их нативные
свойства, например, структуры биологических мембран клетки, от которых зависят
физиологические функции клетки, структуры и специфические свойства нуклеиновых
кислот, которые участвуют в передаче генетической информации, структуры
ферментов, важнейших регуляторов метаболизма, зависят от так называемых слабых
химических связей. Имеются в виду силы Ван-дер-Ваальса, водородные связи, диполь-дипольное взаимодействие. Их энергия находится в
пределах 1-4 ккал/моль. Второй фактор состоит в том, что атомы и молекулы, из
которых состоят живые ткани, находятся в постоянном движении и, следовательно,
обладают кинетической энергией. При 37оС кинетическая энергия
свободных молекул воды в среднем составляет около 1 ккал/моль, т.е. близка к
энергии слабых связей /Hochachka, Somero, 1973/. Волны структурной перестройки,
волны конформационных изменений в мембране,
обеспечение проведения возбуждения, с наибольшей легкостью осуществляется
именно в зоне равной вероятности, т.е. в зоне фазового перехода. В диапазоне
36-42оС обеспечивается максимальная скорость проведения возбуждения
по нерву. Эта скорость резко падает при температурах, меньших или больших
оптимальной /Шноль, 1979/. Именно в диапазоне
37,4±0,4°С внутриклеточная вода обладает
уникальными свойствами: квазикристаллической
структурой и низкой вязкостью /Тринчер, 1965/. Можно
сказать, что тепло отнюдь не «бесполезно» рассеивается в тканях, а
поддерживает оптимальную температуру, при которой биологические процессы
протекают в наиболее благоприятных условиях и с наименьшими затратами энергии.
Отметим, что этот температурный участок приблизительно разделяет температурный
диапазон жидкой фазы воды по золотой пропорции.
При любой гипертензии обеспечивается
оптимальное температурное
«вхождение» в капиллярно-тканевую призму. Температура крови и сердечной ткани
остаются на постоянном уровне, что является одним из важнейших условий их
оптимального функционирования. Таким образом, в капиллярно-тканевых призмах
осуществляется энергооптимальная гармония между
гемодинамическими, кислородными и тепловыми параметрами.
5.8. Источники экономии энергии и живого
вещества
в гемокапиллярной системе сердца
Выше нами было представлено оптимальное вхождение
параметров архитектоники и гемодинамики на транспортном и обменном участках.
Рассмотрим более подробно оптимальность сопряжения гемодинамических и
кислородных параметров в системе «Капилляр c движущейся кровью».
В целом оптимальная «гемодинамическая» организация
капилляра обусловлена оптимальной величиной коэффициента перфузии αK(βЗС) = lK(βЗС)/dK(βЗС) = 160 с-1; этой величине
соответствует минимальность суммарного расхода механической и химической
энергии в капилляре. Покажем, что все параметры, входящие в αK(βЗС) и
связанные с ними, сами по себе имеют оптимальные значения. Как было показано
нами выше, диаметр сосуда dK определяет величину ξK и bK. Величина dK=5,5 мкм /Bassingthwaighte et al., 1974/ соответствует минимально возможной
величине вязкости крови; при дальнейшем сужении сосудов вязкость крови резко
возрастает /Chien, 1975/. Время пребывания эритроцитов в капилляре tK(βЗС)=0,25 сек соответствует времени «разряда»
на наиболее крутом, логарифмическом участке кривой насыщения гемоглобина
/Цветков, 2004/. Оптимальная величина bK(βЗС)=19.300 эрг см-3 с-1
/Murray, 1926b/. C учетом этой величины и оптимальных величин dK(βЗС)=5,5
мкм, tK(βЗС)=0,25 с оптимальная длина капилляра lK(βЗС)=220 мкм. Отметим, что при
установленных величинах lK(βЗС) и tK(βЗС) линейная скорость эритроцитов в
капилляре составляет 880 мкм с-1, что соответствует экспериментальным данным /Чижевский, 1959; Мчедлишвили, 1989/. Время пребывания эритроцитов в
капилляре зависит не только от длины капилляра, но также и от величины
приложенного давления ΔPK(βЗС). Давление на артериальном конце
капилляра даже при максимальной гипертензии (β=2) не должно превосходить величины
ζK(β) = βζK(βЗС), (5.31а)
Необходимо
отметить при этом, что механическая и химическая мощности в каждом сосуде
соотносятся между собою как числа числа Фибоначчи
(1:2). Очевидна оптимальность «вхождения» множества архитектонических,
гемодинамических и кислородных параметров в систему «Капилляр с движущейся
кровью». Таким образом, мы имели возможность убедиться, что все
конструкционные и гемодинамические параметры в золотом режиме входят в систему
«Капилляр с движущейся кровью» оптимальным образом.
С другой стороны, в капилляре значения
гемодинамических параметров сопряжены с оптимальными величинами кислородных
параметров. Величина времени пребывания эритроцита в капилляре tK(βЗС)=0,25 c
связана с пределами наиболее выгодного, «крутого» участка кривой насыщения
гемоглобина. Эритроцит, отдавая кислород с максимальной скоростью UK(βЗС)=220%/c, за это время полностью «вписывается» в логарифмический
сегмент кривой ΔHbO2K(βЗС) =55%.
На этом участке диффузия кислорода происходит при минимальной разности ΔрО2
на концах капилляра, что обеспечивает минимальный разброс величин рО2
по объему сердечной ткани. Протекание крови через
капилляр сопровождается сложными физико-химическими процессами /Гончаренко,
1998/. Вокруг эритроцита создается высокочастотное поле, которое создает между
поверхностью эритроцита и стенкой капилляра эффект скольжения и препятствует
прилипанию. При вхождении в капилляр эритроцит
принимает парашютообразную форму /Skalak, Branemark,
1969/; при такой форме эритроцит отдает кислород со значительно большей
скоростью (~в 2 раза), чем при цилиндрической /Mochizuki, Kagawa, 1973/. Отметим важное обстоятельство: диффузия кислорода из
единичного объема сосуда имеет в капиллярах «цену», меньшую, чем в любой другой
генерации микрососудов.
Таким образом, отдельный капилляр имеет ортимальную «гемодинамическую» организацию (режим
«минимальной работы»). Он же имеет оптимальную «диффузионную» организацию
(минимальный диаметр, оптимальная длина, коническая форма сосудов, парашютообразная форма эритроцитов). Между длиной и
диаметром капилляра, скоростью движения в нем эритроцитов и необходимым
временем десатурации имеется определенное оптимальное
«согласование» с другими звеньями цепочки обменных микрососудов. Можно сделать
вывод, что имеет место энергооптимальная
гармония между двумя «ипостасями» капилляра – гемодинамической и диффузионной.
Капилляры, как мы уже отмечали, являются звеньями
диффузионных цепочек. Пространственное расположение этих цепочек представлено в системе
«Капиллярно-тканевая призма». Эта система является первичной ячейкой всей
системы капиллярно-кислородного обеспечения сердца. Естественно предположить,
что система капиллярно-кислородного снабжения сердца «сконструирована» так,
чтобы обеспечить адекватное кислородное обеспечение сердца при минимально
возможной плотности капиллярной сети. Экономия капилляров соответственно
означает экономию энергии, крови и сосудистого материала и в других генерациях коронарного
русла. Проанализируем основные источники экономии капилляров. Важнейшим
источником экономии капилляров является максимальная скорость диффузии
кислорода из этих сосудов. Кислородное обеспечение сердечной ткани при
максимальной скорости позволяет значительно увеличить расстояние между
капиллярами (до величины, при которой еще адекватно обеспечивается уровень
метаболизма сердечных клеток). Оптимальность пространственного вхождения
отдельного капилляра в призму определяется, как мы уже показали выше,
асимметрией его концов по отношению к соседним капиллярам. Показано /Grunewald, Sowa, 1978/, что наименьший разброс величин рО2 в сечениях
призмы при прочих равных условиях соответствует асимметричному смещению концов
соседних капилляров (ребер) относительно друг друга на полдлины капилляра. При
таком пространственном смещении обеспечивается практически одинаковое
распределение рО2 в каждом сечении призмы. Естественно, что при
другом взаимном смещении капилляров (большем или меньшем полдлины)
аналогичность распределений по длине мышечного волокна нарушается. Как
следствие этого, минимальные рО2 в некоторых сечениях призмы имеют
меньшую величину, чем при оптимальном варианте. Для компенсации этого
недостатка потребовалась бы увеличение плотности капиллярной сети для того,
чтобы в «слабых» сечениях достичь допустимой минимальной величины рО2.
Таким образом, оптимальное пространственное смещение капилляров в
капиллярно-тканевой призме позволяет в конечном счете снизить плотность
капиллярной сети. Естественно, что минимизация плотности капиллярной сети
обусловливает, в свою очередь, минимизацию общего количества сосудов на гемоартериальном и венозном участках коронарного русла.
Аспекты дополнительной экономии капилляров, связанные со структурой кардиомиоцитов будут рассмотрены нами в параграфе 5.9.
В заключение можно сказать, что система «Капилляр с
движущейся кровью» во всех представлениях (гемодинамическом, диффузионном и
тепловом) входит в систему «Капиллярно-тканевая призма» энергооптимальным
образом.
5.9. Оптимизация структуры кардиомиоцита
Клетка – конечный пункт сложного пути молекул
кислорода из крови через стенку сосуда и межклеточное пространство в цитозоль и митохондрии клетки. Рассмотрим оптимизацию
сопряжения «качества» и «количества» поступающего кислорода и структурных
элементов клетки. Величины рО2 в цитозоле
клеток неодинаковы и обнаруживают своеобразное распределение. Джонс /Jones, 1986/ проанализировал
возможные причины такого распределения и пришел к выводу, что неравномерность
величин рО2 в клетке объясняется расположением митохондрий. Митохондриальные кластеры (группировки) ведут к резкому
понижению рО2 в соответствующем месте цитозоля.
Концентрация кислорода в цитозоле оказывается
довольно низкой; окислительные реакции – основной источник энергии – протекают
там при низком рО2 (порядка нескольких мм рт.
ст.). Установлено, что мембраны оказывают сравнительно малое влияние на
диффузию кислорода. Клеточная мембрана, окружающая клетку, и мембраны
внутренних ее частей (в том числе и мембрана митохондрий) играют небольшую роль
в образовании градиента рО2 на пути от внеклеточной среды до цитозоля. В миоцитах сердечной
мышцы рО2 в среднем составляет 3,4 –
Движение кислорода в кардиомиоците
связано как со свободной диффузией, так и с перемещением молекул оксимиоглобина
в кардиомиоците /Коробов, Голубий,
1993/. Кислородтранспортная и кислороддепонирующая
функции миоглобина исключительно важны на участке сарколемма - митохондриальная мембрана, где колебания рО2
могут быть лимитирующим фактором окислительного фосфорилирования.
Способность молекул миоглобина выполнять функции связывания и транспорта
кислорода позволяет обеспечить бесперебойный поток последнего в систему окислительного
фосфорилирования. Специфическое ускорение переноса О2
при естественной концентрации миоглобина 0,7 об.%
увеличивает перенос на 50% /Mochizuki, Foster, 1962/. Установлено /Schwarzman, Grunewald,
1978/, что в области 0-
Благодаря способности миоглобина быстро насыщаться
кислородом его оксигенация остается постоянной в
течение всего сердечного цикла /Carver, Bradbury, 1984/. За счет оксимиоглобина
минимизируется гетерогенность снабжения кислородом из
капилляров /Gayeski, Honig, 1991/. Миоглобин действует также как
ловушка, которая предотвращает диффузию из сегмента одного сердечного капилляра
в сегмент соседнего капилляра с более низким рО2. Концентрация
миоглобина в субэндокарде
на 10-15% выше, чем в субэпикарде. Однако разницы рО2
между этими слоями не существует. Экспериментально показано /Whalen et al., 1973/, что величина рО2 в
миоглобине одинакова в левом и правом желудочках. Очевидно, что миоглобин
является элементом системной регуляции, устанавливающим величину парциального
давления кислорода на уровне нормы по всему миокарду. Локализация митохондрий и
миоглобина в кардиомиоците совпадают. Митохондрии в сердечных клетках ориентированы таким
образом, что наибольшая концентрация митохондрий приходится на часть клетки,
ближнюю к капилляру; по мере удаления от капилляра концентрация митохондрий
снижается /Kayar, Banchero, 1986/. Вследствие этого часть молекул
кислорода с низкими рО2 диффузионно
поступает в «ближние» митохондрии, а другая часть транспортируется молекулами
миоглобина вглубь кардиомиоцита. Если бы отсутсвовало
пограничное расположение митохондрий и не было бы миоглобина, то для
адекватного обеспечения клетки кислородом по «качеству» и «количеству» потребовалась
бы капиллярная сеть повышенной плотности. Таким образом, оптимальное
пространственное расположение митохондрий и молекул миоглобина в клетке
обеспечивает наиболее благоприятные условия для кислородное обеспечение
кардиомиоцита. Очевидно, что наличие «миоглобинного»
переноса кислорода внутри клетки позволяет значительно увеличить скорость
отдачи кислорода из отдельного капилляра; тем самым обеспечивается значительное
сокращение количества открытых капилляров в единичном объеме сердечной мышцы.
Необходимо обратить внимание
на сопряжение кривых двух дыхательных пигментов: гемоглобина и миоглобина на
уровне капилляра. Напряжение кислорода на артериальном конце капилляра в
золотом режиме гипертензии равно
Поверхность митохондриальных
крист необычайно велика. Кристы
митохондрий содержат ферменты дыхательной цепи, которые участвуют в
освобождении энергии для синтеза АТФ. Благодаря «выбору» рО2=5,3 мм рт. ст. в качестве «рабочей» точки митохондрии для
адекватного исполнения своей функции обходятся минимальным количеством
дыхательных цепей, а следовательно, и минимальной складчатой поверхностью.
По мнению Н.С.Печуркина /Печуркин, 1988/, в
клетке можно выделить 3 основных аспекта биологической организации: 1)
биохимическое единство, 2) экономия материала и 3) энергетическая
эффективность. В живых организмах скорость химической реакции всегда достигает предельного
значения, которое определяется законами физики. Во всех случаях обнаруживают
«оптимальное соотношение тенденции «как можно быстрее» и «настолько точно, как
это нужно», пишет в своей книге лауреат Нобелевской премии М.Эйген
и Р.Винклер /Эйген, Винклер, 1979, с. 96/. Следовательно, за счет максимальной
скорости химических реакций, клетка для обеспечения своей жизнедеятельности
обходится минимальным количеством энергии и минимальным объемом клеточных
компонентов.
Остановимся еще на одной
немаловажной особенности клеточной организации. Это энергетическая
экономичность генетического кода. Одним из ее проявлений является корреляция
между распространенностью аминокислоты в белках и энергетической стоимостью ее
синтеза. Чем выше затраты АТФ на синтез данной кислоты, тем реже входит она в
состав белков. Энергетическая эффективность синтеза белка у организмов, которые
синтезируют все необходимые аминокислоты, выше на 20% , чем у не синтезирующих,
а потребляющих извне аминокислоты. Кроме того, для синтеза незаменимых
аминокислот требуется большее число ферментов, чем для синтеза заменимых, что
также связано с дополнительными тратами вещества и энергии. Таким образом,
энергетическая оптимальность генетического кода является дополнительным
источником экономии митохондрий и кислорода, а в конечном счете и количества
открытых капилляров.
Важнейшими источниками экономии
митохондрий в кардиомиоците является структура саркомеров, температура внутриклеточной воды и величина внеклеточного
рН. В покое в конце диастолы длина растянутого
саркомера в кардиомиоцитемлекопитающих
составляет 2,2 мкм; этой длине соответствует максимальная мощность последующего сокращения /Sonnenblick, Downing, 1963; Spiro, Sonnenblick, 1964/ при минимуме потребления кислорода
на единицу призводимой работы /Siess
et al., 1986/. Использование наиболее
эффективных и экономичных саркомеров позволяет
мышечной клетке обойтись их минимальным количеством для создания адекватной
силы сокращения /Tsvetkov, 1998/. Естественно, сокращается при этом
и количество митохондрий, поскольку потребление кислорода на единицу
создаваемого напряжения минимально. Сердечная мышечная клетка для создания
«заданного» тягового усилия обходится минимальным количеством саркомеров и митохондрий. Естественно, что сильные и
экономичные саркомеры являются еще одним источником
экономии капилляров
по всему объему сердечной мышцы. Вода при клеточной температуре 36,8оС
обладает уникальными свойствами /Бочков, 1974; Колясников,
1995/. При этой температуре теплоемкость воды минимальна и поэтому расход
энергии для поддержания этой температуры минимален. Установлено также /Berg, 1962/, что при рН
7,40 во внеклеточной среде скорость дыхания сердечных митохондрий максимальна.
Благодаря этому феномену происходит дополнительная минимизация количества
митохондрий. Естественно, что «подбор» оптимальных параметров и структур
обеспечивает минимизацию потребления кислорода кардиомиоцитом.
Кардиомиоциты исполняют свою функцию с
привлечением минимального количества саркомеров,
митохондрий и других субклеточных единиц. За счет этого сокращается
количество потребляемого кислорода и как следствие снижается плотность
капиллярной сети.
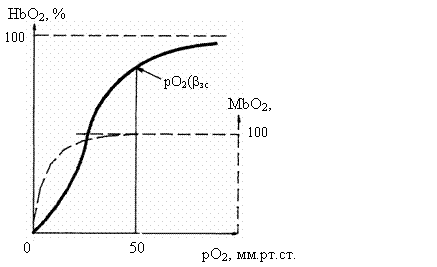
Рис. 5.8. Сопряжение кривых насыщения гемоглобина и миоглобина

Согласно данным /Page et al., 1972/ 34% объема сердечной клетки
составляют митохондрии, 48% - миофибрилы, 1,5% -
Т-система и ретикулум и 16,5% - другие компоненты. (В
отношении объемов энергопроизводящих и –потребляющих
частей кардиомиоцита опять «присутствуют»
числа Фибоначчи – 1:2!) Из вышеизложенного следует, что именно при таком
соотношении в кардиомиоците имеет место, с одной
стороны, наиболее эффективное функционирование сердечных клеток, и с другой
стороны, дополнительная минимизация объема капиллярной сети. Оптимальное
вхождение субклеточных структур в систему «Кардиомиоцит»
позволяет последнему исполнять свою функцию с минимальными затратами энергии и
строительного материала. В конечном счете налицо энергооптимальное
вхождение «поставщика» и «потребителя» кислорода в систему «Капиллярно-тканевая
призма».
Другим важнейшим показателем эффективности
функционирования кардиомиоцита является максимальность отношения боковой
поверхности к его объему. Кардиомиоцит можно
представить в виде кругового цилиндра, где отношение боковой поверхности к
объему S/V=4/d (d – диаметр
мышечной клетки). Естественно, чем меньше диаметр такой клетки, тем выше в ней
допустимый уровень метаболизма. Покажем, что отношение имеет максимальное значение. С этой целью
рассмотрим особенности пространственной организации субклеточных структур. Саркомеры являются «силовой» частью клетки.
Отметим, что средние длины саркомеров
одинаковы в передней и задней стенках левого желудочка
/Guccione et al., 1997/. В плоскости, перпендикулярной к длине саркомеров, сечения миозиновых
нитей располагаются по вершинам равносторонних треугольников, а актиновых в их центре /Huxley, 1969/ (рис. 5.9). Такой способ упаковки соответствует наиболее плотному
расположению множества взаимодействующих элементов на заданной площади /Тот, 1958/. Максимальная плотность упаковки актиномиозиновых комплексов позволяет свести к минимуму их
количество в поперечном сечении клетки и значительно улучшить условия
взаимодействия актиновых и миозиновых
нитей. Эффективно используют пространство кардиомиоцита и энергопроизводящие
структуры кардиомиоцита. В сердечной клетке митохондрии располагаются между
миофибриллами, под сарколеммой и у полюсов ядер /Глаголева,
Чечулин, 1980/. Снаружи каждая мембрана покрыта трехслойной ограничивающей
мембраной. Лежащая под ней трехслойная мембрана образует многочисленные складки
и впячивания – кристы,
направленные вглубь ми-
Рис. 5.9. Взаимное
расположение актиновых и миозиновых
нитей в поперечном сечении кардиомиоцита. l - миозиновые
нити, · - актиновые нити.
тохондрий.
Складчатая поверхность позволяет разместить во много раз большее количество
функциональных частиц, чем гладкая. Таким образом, складчатость структуры
митохондрий позволяет значительно уменьшить размеры клетки. Расположение
линейных полимеров ДНК по двойной спирали также позволяет осуществить их
наиболее плотную упаковку и свести к минимуму объем ядра. Максимально плотная
упаковка саркомеров, ядра, митохондрий и,
по-видимому, других структур позволяет свести диаметр мышечной клетки к
минимуму. Аналогичная картина имеет место и для капилляра, где S/V=4/d также равно максимальной величине. Таким образом, энергооптимальная гармония «вхождения»
субклеточных структур в систему «Кардиомиоцит»
обеспечивает, с одной стороны, максимальное производство механической
энергии, минимальное потребление кислорода и строительного материала и, с
другой стороны, обеспечивает максимальный уровень метаболизма. Таким
образом, имеет место энергооптимальная гармония
сопряжения систем «Капилляр» и «Кардиомиоцит». За
счет этого обеспечивается оптимальность вхождения архитектонических,
гемодинамических, кислородных и субклеточных
параметров в систему «Капиллярно-тканевая призма».
5.10. Оптимальная конструкция
артерио-капиллярного русла
сердца млекопитающих
В 3, 4 и данной главе был произведен
математический анализ конструкции транспортного, обменного и капиллярного
участков коронарного русла. Теперь представляется возможным представить общий
план «сборки» всего артериально-капиллярного
комплекса сердца млекопитающих. Изберем некоторую последовательность шагов по
«сборке» этого комплекса. Ядром всего коронарного русла, несомненно, является
сеть капилляров. Оптимальная плотность капиллярной сети сердца, как мы могли
убедиться, обусловлена экономичным потреблением кислорода в единичном объеме
ткани и особенностями взаимного расположения гемососудистых
и тканевых элементов. Природа избрала такую конструкцию отдельного капилляра,
которая позволяет ему наиболее эффективно исполнять свою «кислородную» функцию.
Этой задаче отвечает оптимальный «подбор» величин dK(βЗС),
lK(βЗС), ξK(βЗС), tK(βЗС) и bK(βЗС); этим величинам
соответствуют оптимальные по отношению к затратам механической и химической
энергии значения qK(βЗС)
и ΔPK(βЗС). Капиллярное русло
построено в полном соответствии с физиологическими требованиями и принципом
оптимального вхождения.
«Подбор» величин dj(βЗС), lj(βЗС), ξj(βЗС) и bj(βЗС) в каждой j-генерации транспортных, обменных и
артерио-капиллярных тройников осуществляется при соблюдении энергоптимальных
соотношений
WM1(βЗС)/WX1(βЗС)=WM2(βЗС)/WX2(βЗС)=WMС(βЗС)/WXС(βЗС)=0,5, (5.32)
где WС(βЗС), WМС(βЗС), WХС(βЗС), W1(βЗС), WМ1(βЗС), WХ1(βЗС), W2(βЗС), WМ2(βЗС), WХ2(βЗС) -- соответственно расход суммарный
расход мощности и соответственно механической и химической мощности в 1 и 2
ветвях тройников в золотом режиме гипертензии.
Оптимальное сопряжение между генерациями
артериальных и капиллярных сосудов соответствует закону
[k(βЗС)H1(βЗС)]3/2 + [k(βЗС)H2(βЗС)]3/2 = 1. (5.33)
Как было показано нами в 2 и 3 главах
законы (5.32) и (5.33) присущи всем докапиллярным
генерациям артериального участка коронарного русла. В настоящей главе было
установлено, что «конструирование» капилярного
участка также происходит с «участием» законов (5.32) и (5.33).
Итак, мы
имели возможность рассмотреть основы оптимальной конструкции артериально-капиллярного комплекса. Необходимо указать при
этом на важнейшую роль диаметра и длины сосудов в построении оптимального артериально-капиллярного комплекса. «Выбор» минимально
возможного диаметра капилляра позволяет получить тот диапазон диаметров артериол, при котором величины S/V имеют
максимальные значения, что обеспечивает максимально возможный уровень
метаболизма в каждом сосуде. «Подбор» минимального диаметра капилляра, как мы
могли убедиться раньше, играет главную роль в подборе количества ветвлений в
соответствии с принципом «минимальной работы». Плотность капиллярной сети за
счет представленных выше аспектов экономии сведена к минимальной величине.
Следовательно, сводится к минимуму общий кровоток в первом коронарном сосуде, а
также и диаметр этого сосуда. Таким образом, экономия капилляров позволяет
уменьшить общий кровоток, а следовательно, и расходы энергии на перемещение
крови по всему коронарному руслу. «Подбор» длины позволяет обеспечить
оптимальную протяженность сосуда, что позволяет регулировать пределы изменения
гемодинамических и кислородных параметров на каждом сосуде. С одной стороны,
чем больше диаметр капилляров, а следовательно, и других сосудов, тем меньше
затраты энергии на перфузию сосудов. С другой стороны, чем больше диаметр, тем
ниже уровень метаболизма в сосуде. Таким образом, «подбор» оптимальных
значений диаметра, длины и плотности представляет энергооптимальную
гармонию требований к гемодинамике и метаболизму в сосудах. Оптимальное
сопряжение диаметров и длин ствола и ветвей в тройнике позволяет «пропустить»
данный кровоток при минимальном суммарном объеме крови и сосудистого материала.
Такое сопряжение позволяет создать своего рода эстафету оптимальностей от одной
генерации сосудов к другой. Очевидно, что артериально-капиллярный
комплекс в целом создан природой с «привлечением» принципов максимальной
экономии энергии и оптимального вхождения.
Универсальный кислородный инвариант, который относится к
микроциркуляторной и капиллярной части комплекса,
U1(βЗС) = U2(βЗС)) = UС(βЗС),
(5.34)
где UС(β), U1(β), U2(β) - соответственно скорость отдачи
кислорода поперечными сечениями ствола, 1 и 2 ветвей.
Энергооптимальные инварианты (5.32)-(5.34) являются общими
для различных видов млекопитающих независимо от их веса и уровня гипертензии.
Эти безразмерные отношения определяют энергооптимальную
гармонию всего транспортно-обменного комплекса. Следует говорить об универсальности
оптимальной конструкции как гемоартериально-капиллярных,
так и кислородных комплексов для всего класса млекопитающих.